中国科大揭示光感知调控血糖代谢的神经机制
| 来源: 中国科学技术大学 【字号:大 中 小】
对栖息于这颗蓝色星球上的生命而言,光是一切生命产生的源动力,也是生命体最重要的感知觉输入之一。同时生命体根据外界环境条件控制体内营养物质的代谢平衡是生存的必须,而代谢紊乱会产生严重疾病,哺乳动物已经进化出了精确和复杂的调控网络用于持续动态调控血糖代谢。大量公共卫生调查显示夜间过多光源暴露显著增加肥胖和糖尿病等代谢疾病风险,那么光作为最重要的外部环境因素,其是否直接调控血糖代谢?其中涉及哪类感光的细胞、何种神经环路以及外周靶器官,这些方面的问题一直没有得到解答。
1月20日,中国科学技术大学生命科学与医学部教授薛天研究团队在《细胞》(Cell)上,在线发表了题为Light modulates glucose metabolism by a retina-hypothalamus-brown adipose tissue axis的研究成果。该工作发现了光直接通过激活视网膜上特殊的感光细胞,经视神经至下丘脑和延髓的系列神经核团传递信号,最终通过交感神经作用于外周的棕色脂肪组织,直接压抑了机体的血糖代谢能力。值得指出的是,这项工作不但在小鼠动物模型上系统回答了光调节血糖代谢的生物学机理,在人体试验上也发现了同样的现象,显示光调节血糖代谢可能广泛存在于哺乳动物界。
研究人员首先对小鼠和人执行葡萄糖耐受性检测(GTT),发现数个小时的光暴露显著降低了人和鼠的血糖耐受性。哺乳动物光感受主要依赖于视网膜上的各类感光细胞。除了经典的视锥(Cones)视杆(Rods)细胞介导图像视觉感知之外,光也能直接激活视网膜上的第三类感光细胞视网膜自感光神经节细胞(ipRGC),它依靠自身表达的视黑素(Melanopsin)对波长靠近480nm的短波长蓝光敏感。ipRGC支配诸多下游脑区进而调控如瞳孔对光反射、昼夜节律、睡眠和情绪认知功能。光降低血糖耐受性通过何种感光细胞介导?通过基因工程手段,研究人员逐一使视网膜各类感光细胞丧失感光能力,发现光诱发血糖不耐受由ipRGC感光独立介导(图1)。
接着研究人员进一步探究视网膜至脑内的哪些核团参与光调节糖代谢。下丘脑是调控机体代谢的重要区域,其中与ipRGC有较密集连接的是下丘脑视交叉上核SCN和视上核SON核团。已知数周异常光照模式能够通过影响节律中枢SCN,造成生物钟节律失调,进而间接影响到血糖代谢功能。研究人员分别损毁或利用化学遗传手段操控ipRGC投射的SCN和SON核团,发现了光急性降低血糖耐受性这一过程独立于生物钟节律系统,而由ipRGC-SON的神经环路直接介导(图1)。
结合大量神经环路示踪和操控手段,研究人员进一步发现ipRGC→SONOXT(视上核内催产素(Oxytocin)能神经元)→SONAVP(SON内抗利尿激素(Vasopressin)能神经元)→PVN(下丘脑室旁核)→NTSVgat(孤束核的GABA能抑制性神经元)→RPa(中缝苍白核)这样一条脑内六级长程神经环路介导光降低血糖耐受性(图1)。
光影响血糖代谢必然通过外周血糖代谢的器官来执行,考虑到在环路水平上光降低血糖耐受通过中缝苍白核RPa,该核团是调节棕色脂肪组织(BAT)活性的交感前运动神经的主要部位。因此研究人员将研究锁定在棕色脂肪组织,而棕色脂肪组织的重要作用之一是代谢葡萄糖或脂肪,直接产热以维持体温稳态。研究人员发现光能显著压抑棕色脂肪组织的温度,进一步通过阻断交感神经对棕色脂肪组织的投射、以及利用热中性环境温度压抑棕色脂肪组织活性的手段,确定了光降低血糖耐受性是通过压抑脂肪组织消耗血糖的产热所导致(图1)。
夜行性的小鼠和昼行性的人类在诸多光调控的生理过程中表现既有相反也有相同的效应。光是否同样降低人的血糖耐受?研究人员分别使用ipRGC敏感的蓝光与ipRGC不敏感的红光,测试人在不同波长光线照射下的血糖耐受性。结果显示在蓝光照射下人的血糖耐受性显著下降。进一步研究人员将被试者处于热中性温度环境中(热中性温度下棕色脂肪组织活性被压抑)进行了血糖耐受性测试,结果显示光不再压抑血糖耐受。上述实验提示光降低人的血糖耐受性可能也是由ipRGC感知光线且通过影响棕色脂肪组织的活性所介导(图2)。
对这项工作的几点启示:
Nothing in biology makes sense except in the light of evolution,光压抑血糖代谢这一神经生理功能可能用于动物快速响应不同太阳辐照条件,以维持体温稳态。在户外环境中太阳光可以为动物提供大量的热辐射,这可以满足部分的体温维持需求,而在动物进入洞穴或树荫等诸多太阳光辐照显著降低的环境中时,机体就需要迅速响应这种辐照减少带来的热量输入损失。光通过这条“眼-脑-棕色脂肪”通路快速减低脂肪对葡萄糖的利用以降低产热,在光辐照减少的时候,棕色脂肪不再被光压抑,快速代谢血糖来维持体温稳态。
冷暖光也许并非单纯心理作用,可能存在生理基础。日常生活中短波光环境(蓝)让人感觉到凉爽,而长波光环境(红)让人觉得温暖,因此它们才被赋予了冷暖光的定义。冷暖色一直被定义为心理上的冷热感受。这项研究发现对短波长光敏感的ipRGC在蓝光下压抑脂肪组织产热,而在红光下脂肪组织处于活跃状态。因此我们在进入蓝光环境下产生的那种“冷”的感觉,有可能是由于脂肪产热被压抑而产生的真实感受。 这条光调控脂肪组织活性的环路可能是心理上冷暖光的生理结构基础。
工业化时代的代谢疾病—人造光源增加机体代谢负担。该项工作在人体的研究结果显示,昼夜节律会造成夜间人体的糖代谢能力相较白天更低,而光压抑血糖代谢是直接叠加在节律造成的夜间血糖代谢能力下降之上的(图2)。因此在夜间同时有光暴露的条件下,人体血糖代谢能力最差。工业化社会中,人类长时间的在夜间暴露于人造光源之下,加上现代人夜间饮食习惯给机体带来双重代谢负担进而可能诱发代谢疾病。大量公卫卫生学证据已经证实了这一点,最近瑞金医院宁光院士团队涉及近10万人的研究显示,夜间长期暴露于人造光下会增加血糖紊乱及糖尿病的患病风险。
这项光调节血糖代谢的机制研究,提示现代人健康生活应关注光线环境的健康,针对夜间光污染造成的罹患代谢疾病风险提高,应考虑生活环境中夜间人造光线的波长、强度和暴露时长。这项工作发现的感光细胞、神经环路和外周靶器官可为将来干预此过程提供潜在靶点。
研究工作得到国家自然科学基金、科技部、科学探索奖、中科院稳定支持基础研究领域青年团队项目、中国科大等的支持。合肥学院科研人员参与研究。
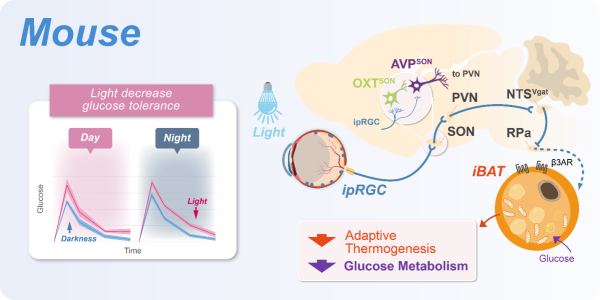
图1.在小鼠上,光激活ipRGC-SONOXT-SONAVP-PVN-NTSVgat,压抑RPa和支配脂肪的交感神经,进而压抑棕色脂肪产热降低血糖耐受性。
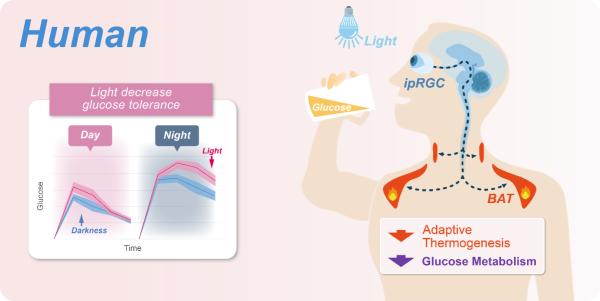
图2.在人上,光可能通过同样的神经环路机制压抑棕色脂肪产热降低血糖耐受性。相较于白天,夜晚人的血糖耐受性更低。
