科学家揭示成瘾药物作用靶点TAAR1的分子识别机制
| 来源: 分子细胞科学卓越创新中心 【字号:大 中 小】
11月7日,中国科学院分子细胞科学卓越创新中心汪胜研究组、上海科技大学iHuman研究所徐菲研究组、中国科学院上海药物研究所徐华强研究组与上海市刑事科学技术研究院合作,在《自然》(Nature)上,在线发表了题为Recognition of methamphetamine and other amines by trace amine receptor TAAR1的研究成果。
甲基苯丙胺(Methamphetamine,METH,冰毒的主要成分)被滥用时,对人类健康和社会秩序产生严重危害,但目前尚无可用于治疗METH成瘾的上市药物。METH成瘾主要通过调控多巴胺释放和再摄取产生作用,这一机制已得到广泛认可。最新研究表明,METH可以直接与痕量胺相关受体1(Trace Amine-Associated Receptor 1,TAAR1)结合,并激活受体下游的G蛋白信号通路,这可能是METH在体内进行信号转导的关键节点。此外,TAAR1被认为在调节METH和其他胺类分子(如内源性苯乙胺)以及精神分裂症等临床候选药物分子的神经生物效应中发挥关键作用。因此,运用结构生物学研究手段探究METH以及其他胺类分子与TAAR1之间的相互作用机制,将有望为治疗药物成瘾和研发新型抗精神类药物提供重要的推动力。
TAAR1是一种G蛋白偶联受体,主要分布在大脑中,能够识别多种生物胺类物质,包括内源物质β-苯乙胺(β-PEA),并参与神经递质的调节。与其他痕量胺受体不同,TAAR1主要分布在大脑的单胺能核团及其投射区。例如,多巴胺能神经元胞体所在的腹侧被盖区和黑质致密部、5-羟色胺能神经元胞体所在的中缝核以及它们的靶区如伏隔核和杏仁核等脑区。这与TAAR1在调节奖赏、认知和情感等方面的关键作用高度一致。因此,TAAR1的独特生理功能与多种精神疾病密切相关。大量研究表明,TAAR1激动剂对治疗精神分裂症、抑郁症和药物成瘾具有潜力。
该研究利用冷冻电镜技术首次确定了人源TAAR1-Gs蛋白复合物分别与METH、内源配体β-PEA,以及选择性激动剂RO5256390和临床候选药物SEP-363856激活后的高分辨率结构。结构分析发现,METH定位在TAAR1的正构结合口袋中,主要通过与第103位的天冬氨酸和第294位的酪氨酸形成的极性相互作用来特异性地与TAAR1结合。此外,配体结合口袋及其周围氨基酸所形成的氢键网络有助于稳定配体与TAAR1的相互作用。TAAR1中的第二个胞外环(ECL2)形成独特的“盖子”结构,利用特异性较高的第186位苯丙氨酸以及其他疏水氨基酸,直接或间接地参与配体的相互作用,形成了TAAR1特有的分子识别机制。与内源配体β-PEA相比,METH与关键残基第103位的天冬氨酸和第107位的丝氨酸的极性相互作用较弱,导致其与TAAR1的亲和力下降,这可能是β-PEA比METH更高效结合TAAR1的结构基础。分子动力学模拟以及系统的突变与功能实验验证了上述结论。
综上,这一研究系统性地揭示了METH和其他胺类化合物与TAAR1相互作用的关键结构要素,为治疗药物成瘾和神经精神疾病的新药研发奠定了坚实的理论基础。同时,TAAR1作为单胺类系统的最后一个未解析结构的受体,该研究推进了现有胺能受体结构领域的研究,对于探索单胺类系统的药理学具有重要意义,有望推动新一代更安全高效药物的开发。
研究工作得到国家重点研发计划、国家自然科学基金和上海市科学技术委员会等的支持。
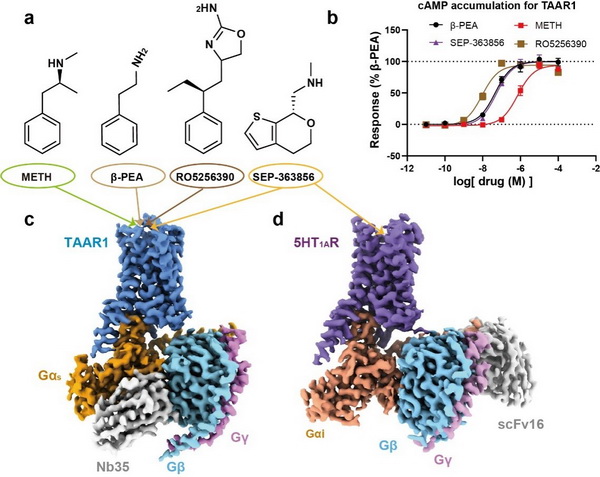
四种TAAR1激动剂激活TAAR1的功能评估以及TAAR1-Gs、5HT1A-Gi复合物的整体结构。(a)四种TAAR1激动剂的结构式;(b)四种配体激活TAAR1的功能评估;(c-d)TAAR1-Gs、5HT1A-Gi复合物的整体结构密度图。
