科学家在小鼠体内生成大鼠前脑组织
| 来源: 脑科学与智能技术卓越创新中心 【字号:大 中 小】
4月25日,中国科学院脑科学与智能技术卓越创新中心杨辉组和周海波组、美国得克萨斯大学西南医学中心吴军组联合中国科学院动物研究所郭帆组,在《细胞》(Cell)上在线发表了题为Generation of rat forebrain tissues in mice的研究论文。该研究提出了高效的异种囊胚互补系统,首次在小鼠体内生成了功能性的大鼠前脑组织,揭示了异种前脑补偿嵌合体背景下细胞发育的自主性和非自主性的影响。这一成果对于在进化背景下探讨脑进化的机制具有重要意义。
利用干细胞生成功能性的器官或组织是干细胞研究的热点。异种囊胚互补技术使得在一物种内培育出另一种物种的器官或组织成为可能。该技术通过将多能干细胞注入到缺失关键发育基因的宿主囊胚中,由供体细胞补偿宿主缺失的器官或组织,培育出源自另一物种的器官。先前研究已在小鼠中培育出大鼠的胰腺、胸腺、血管内皮组织和生殖细胞,并在大鼠中培育出小鼠的胰腺、肾脏和生殖细胞。目前,尚未能在异种囊胚中培育出大脑组织。在一物种中培育另一种物种的大脑组织,将有助于科研人员在进化的角度研究大脑的发育与功能。
传统的囊胚互补方法涉及构建影响特定器官发育的杂合基因突变小鼠。繁育这些小鼠以产生具有基因突变的囊胚,并将供体细胞注入这些突变囊胚中以形成囊胚互补嵌合体,这一过程耗时耗力且不适用于杂合致死的基因。利用传统囊胚互补方法来验证特定基因是否能支持某个器官的囊胚互补是漫长的过程。为突破这些限制,该研究引入了C-CRISPR技术。C-CRISPR技术通过使用多个gRNA结合Cas9来实现几乎100%的基因敲除效率,避免了基因编辑动物的需要。研究结合C-CRISPR技术和囊胚互补技术,创建了名为CCBC新系统。该系统允许快速验证目标基因是否适合囊胚互补,并能够一步生成器官重构嵌合体。
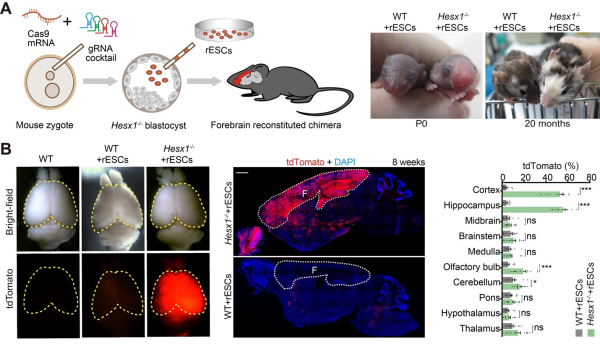
该研究通过CCBC系统筛选到能够支持前脑互补的基因Hesx1。通过C-CRISPR敲除小鼠受精卵里的Hesx1基因以阻止宿主细胞向前脑发育,让受精卵发育到囊胚阶段,进而分别向基因突变的小鼠囊胚腔里注射小鼠胚胎干细胞(mESCs)或大鼠胚胎干细胞(rESCs)以补偿宿主缺失的前脑组织。研究采用上述方法,获得了小鼠-小鼠前脑互补嵌合体(Hesx1-/- +mESCs)以及大鼠-小鼠前脑互补嵌合体(Hesx1-/- +rESCs)。
研究显示,所有Hesx1-/- +rESCs和Hesx1-/- +mESCs嵌合体均存活至成年,并呈现与传统嵌合体(WT+mESCs)相似的体重生长曲线。研究发现,在这些嵌合体的大脑皮层V层和海马中,均检测到表达CTIP2的细胞。在大脑皮层和海马中,无论是Hesx1-/- +rESCs、WT+mESCs还是Hesx1-/- +mESCs嵌合体,它们的层厚度和细胞密度均相似。
为了评估Hesx1-/- +rESCs嵌合体中大鼠神经元的功能,科研人员在嵌合体前脑的前外侧运动皮层注入了AAV8-hSyn-EGFP。实验结果显示,由rESC衍生的神经元能够从这一区域向丘脑、上丘和脑干中脑区域投射轴突。电生理测试表明,这些嵌合前脑中的大鼠和小鼠皮层神经元可以随着电流的增加发放不同频率的动作电位。进而,研究确认,在Hesx1-/- +rESCs嵌合体中,大鼠和小鼠细胞、小鼠与小鼠细胞、大鼠与大鼠细胞之间均能形成突触连接。此外,研究通过行为学测试如Morris水迷宫实验、开放场测试和情境恐惧记忆测试,评估了同种和异种前脑补偿嵌合体的前脑功能。测试结果显示,WT+mESCs、Hesx1-/- +rESCs和Hesx1-/- +mESCs嵌合体在这些行为测试中的表现无显著差异,显示重建的前脑功能表现正常。这表明Hesx1-/-小鼠胚胎为供体rESCs提供了适宜的发育环境,帮助其形成功能性的大鼠前脑组织。
皮层和海马的单细胞RNA测序结果显示,大鼠细胞在Hesx1-/- +rESCs嵌合体中形成了多种类型的神经细胞,且种类和占比接近于WT大鼠的前脑组织。不同神经细胞类型下大鼠细胞的转录组更接近于WT大鼠细胞。早期胚胎的切片结果显示,大鼠细胞形成的前脑组织的尺寸和发育进度与宿主小鼠一致。这表明非细胞自主机制决定了器官的大小和发育速度,而细胞自主机制塑造了嵌合体中大鼠前脑组织的整体转录组特征。
该研究通过比较大鼠细胞在嵌合体与WT大鼠中的转录组差异,发现了一些与轴突生成、前脑发育和神经生成调控等相关的差异表达基因。通过细胞相互作用分析,该研究观察到多种潜在的配体-受体相互作用。这可能解释了宿主Hesx1-/-小鼠细胞如何影响供体大鼠细胞以及帮助它们在前脑中存活和分化。
通过CCBC在小鼠体内生成大鼠前脑组织
