上海有机所揭示葡萄糖感知与非经典焦亡之间的分子联接
| 来源: 【字号:大 中 小】
细胞的营养状况和细胞焦亡的发生对宿主抵御感染至关重要。越来越多的研究表明,宿主细胞的营养状况变化如葡萄糖水平变化,对于宿主应对病原体感染具有重要影响。在细菌感染过程中,宿主细胞葡萄糖水平可能发生改变。这种变化或是宿主免疫防御的一部分,因而是有益的;也可能是感染后难以避免的不良后果。事实上,葡萄糖水平变化因不同的病原体感染而异,或促进或抑制感染。细胞焦亡是受调控的细胞死亡过程,而宿主细胞通过焦亡诱导炎症反应,有助于宿主细胞的免疫防御。然而,在微生物感染期间,宿主细胞的营养状况变化与焦亡之间的分子联接尚不清楚。
6月6日,中国科学院上海有机化学研究所生物与化学交叉研究中心许代超团队在《自然-微生物学》(Nature Microbiology)上在线发表了题为Yersinia infection induces glucose depletion and AMPK-dependent inhibition of pyroptosis in mice的研究论文。该研究揭示了葡萄糖感知和耶尔森氏菌诱导的非经典焦亡之间的分子联接,以及耶尔森氏菌通过干扰宿主细胞葡萄糖稳态来逃逸宿主细胞焦亡免疫防御作用的分子机制。
AMPK是细胞内丝氨酸/苏氨酸激酶,也是对代谢应激做出反应的中央能量传感器。AMPK可以感知细胞内下降的能量状态而被激活,还可以通过感知葡萄糖的水平而被激活。在微生物感染期间,宿主细胞被感染后,需要大量的能量来驱动免疫应答。因此,多数细胞内病原菌感染均涉及激活宿主的AMPK。
该研究发现,在耶尔森氏菌感染的早期阶段,耶尔森氏菌可以通过诱导宿主免疫细胞如巨噬细胞内糖酵解水平急剧升高,使得巨噬细胞内葡萄糖水平和小鼠血糖水平迅速而显著下降,最终过度激活宿主体内的AMPK。
通常情况下,宿主细胞被耶尔森氏菌感染后可以激活RIPK1-caspse-8-GSDMD介导的非经典焦亡通路,以限制耶尔森氏菌感染。然而,研究显示,宿主细胞内激活的AMPK可以直接对RIPK1内高度保守的S321位点进行抑制型的磷酸化修饰,限制其激酶活性和随后的caspase-8的激活,从而抑制细胞焦亡的发生,并促进宿主感染的不良反应。
与之相一致的是,研究人员使用AMPK激动剂或葡萄糖缺乏等手段来过度激活小鼠体内的AMPK,均会加重小鼠被耶尔森氏菌感染的程度。而科研人员在巨噬细胞中敲除AMPK或在耶尔森氏菌感染期间给小鼠补充葡萄糖来抑制AMPK的活性,则可以促进小鼠抵抗耶尔森氏菌的感染。
上述工作探讨了耶尔森氏菌感染过程中,葡萄糖稳态改变引起AMPK激活,进而对宿主RIPK1依赖的细胞焦亡的调控作用。进一步,该研究阐明了病原体感染对宿主细胞营养状态变化的调控作用以及这种变化对宿主细胞免疫防御的调节作用。这提示临床上病人营养状况和血糖水平的维持可能对治疗耶尔森氏菌感染具有积极意义。
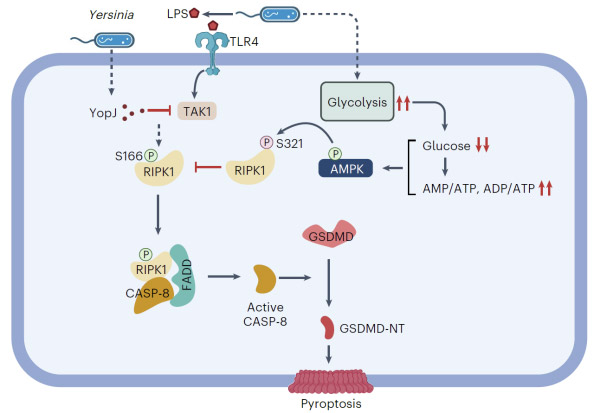
耶尔森氏菌通过干扰宿主细胞葡萄糖稳态激活AMPK逃逸RIPK1介导的细胞焦亡的分子机制
