物理所揭示细胞外排磷酸盐机制
| 来源: 【字号:大 中 小】
细胞膜是保持细胞结构和功能完整性的关键结构元件。同时,细胞膜阻断了物质在细胞内外的自由交换。定位于细胞膜中的膜蛋白包括离子通道和转运蛋白等可以实现物质的跨膜运输,对细胞的物质、能量和信息的交换至关重要。然而,关于离子通道和转运蛋白介导的物质跨膜输运如驱动力、选择性和动力学过程等关键问题有待研究。
中国科学院物理研究所/北京凝聚态物理国家研究中心软物质与生物物理实验室SM10组特聘研究员姜道华致力于物质跨膜运输的研究,在离子通道蛋白和转运蛋白介导的物质跨膜运输方面取得进展。
8月21日,该团队通过冷冻电镜单颗粒技术重构出磷酸盐转运蛋白XPR1处于不同构象的高分辨率结构,首次揭示了XPR1外排磷酸根离子的门控机制和SPX结构域的调控机制。相关研究成果以Human XPR1 structures reveal phosphate export mechanism为题,发表在《自然》(Nature)上。
无机磷酸盐(Pi)是所有生命体必需的常量营养元素,几乎参与所有的生物过程,在物质合成、呼吸作用、光合作用、能量转换、信号传导等生理过程中发挥重要作用。生物体内磷酸盐水平受到严格调控,而磷酸盐的缺失或过量会对生物体造成疾病,如心功能障碍、佝偻病、骨软化症及血管钙化等。XPR1是目前人体中唯一已知的磷酸盐外排转运蛋白,其功能异常会导致人类神经系统疾病原发性家族性脑钙化和肾范可尼综合征。XPR1包含一个可溶的SPX结构域和一个跨膜结构域。其中,SPX结构域是一个保守的多磷酸肌醇(InsPP)传感器。SPX结构域通过监控细胞内InsPP的浓度,调控转运蛋白外排磷酸盐的活性。然而,XPR1外排磷酸根及其活性被SPX结构域调控的分子机制仍然未知。
该研究解析了XPR1处于关闭、开放和结合肌醇-6磷酸的三种不同构象,首次发现了XPR1二聚体形式。基于结构和功能结果,该研究提出了XPR1门控机制和SPX结构域的调控机制模型。XPR1门控机制主要由TM9b的构象变化介导,磷酸根被靠近细胞内内侧的位点一和位于细胞膜中间的位点二识别和结合,通过与W573相互作用,进而引发TM9b构象变化,使XPR1处于打开状态。而SPX结构域可以通过感受细胞内磷酸肌醇的浓度来调控XPR1外排磷酸根离子的通量。也就是说,当细胞内磷酸根浓度较低时,多磷酸肌醇浓度降低,SPX结构域呈动态构象,XPR1的C-loop结合在位点一附近并降低限制磷酸根进入蛋白磷酸根入口;当细胞内磷酸根浓度升高时,多磷酸肌醇浓度升高,SPX结构域结合多磷酸肌醇并转换为稳定构象,稳定状态的SPX结构域与C-loop相互作用,使其远离磷酸根入口,从而加速Pi的外排。由于磷酸根结合位点、TM9和C-loop以及SPX结构域在酵母SYG1、植物PHO1和其他动物中的XPR1中高度保守,因而研究推测这些蛋白应是采用类似的机制来维持Pi的稳态。
研究发现,XPR1的结构类似于转运蛋白,但采取新颖的类似于通道的门控机制外排磷酸根,不同于大多数转运蛋白采用的交替开放的转运机制。同时,该研究首次阐明了SPX结构域通过结合多磷酸肌醇调节XPR1的通量,提出了多磷酸肌醇感知和磷酸跟输出之间的耦合机制。上述成果对人体磷酸根稳态研究至关重要。
研究工作得到国家自然科学基金委员会和中国科学院的支持。冷冻电镜数据收集工作获得物理所SM10组冷冻电镜中心与软物质公共仪器平台以及北京大学现代农业研究院生物微观结构研究平台的技术支持。
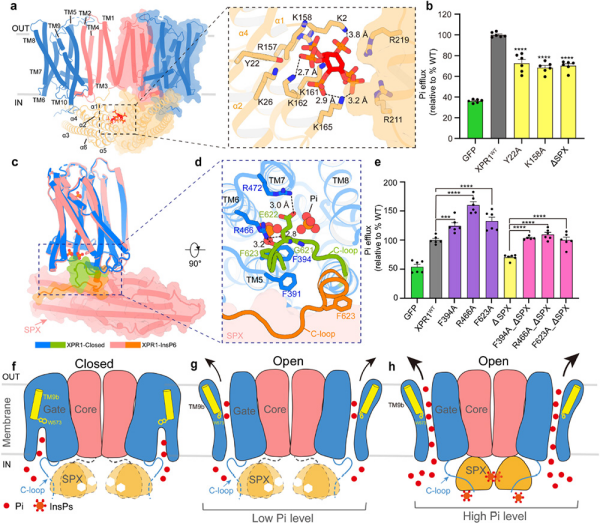
XPR1磷酸盐转运调节机制模型
