活细胞纳米分辨成像探针研制获进展
| 来源: 【字号:大 中 小】
在生命体系中,对生物分子进行原位且纳米尺度的动态监测,有助于揭示生命过程的复杂动态。然而,传统的荧光分子探针往往因亮度不足和光稳定性差,难以满足高时空分辨率下,追踪单个生物分子的需求。明亮且稳定的荧光纳米颗粒,又因其相对较大的尺寸,及复杂不可控的表面修饰,难以实现较高密度的特异性标记,且易对所标记的生物分子的生理行为造成干扰。因此,研制既明亮又光稳定,同时尺寸足够小,以避免干扰生物分子生理行为的荧光探针,是该领域亟待解决的关键问题。
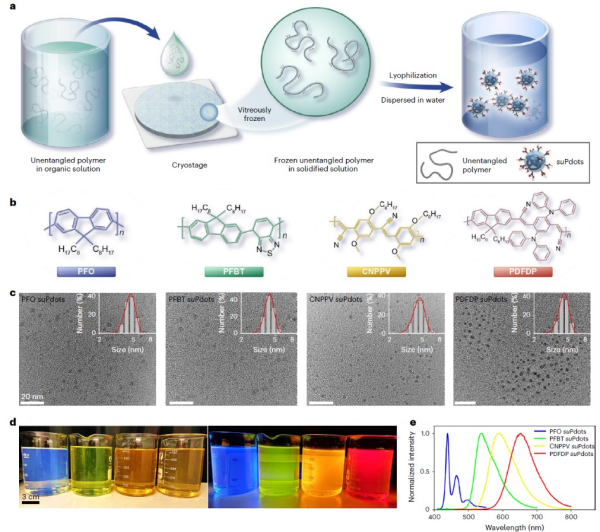
近日,中国科学院理化技术研究所研究员王健君团队联合杭州医学研究所研究员方晓红团队,在揭示冰晶成核与生长机制的基础上,发明冷冻组装策略,将单条有机荧光聚合物链,制备成尺寸<5nm的单链超小荧光聚合物纳米点(suPdots)。这些suPdots组成明确、表面易修饰、荧光发射可调、高亮度和优异光稳定性,为先进荧光显微成像提供了探针工具。
在性能设计与功能优化上,suPdots展现出优势:其一,探针选材兼顾实用性与多样性,选用可商业化获取的共轭聚合物链,且荧光光谱覆盖全光谱范围,满足不同场景的成像需求;其二,光物理特性优异,单颗粒亮度约为绿色荧光蛋白的15倍,且不同结构的荧光聚合物链,可呈现差异化单颗粒光学行为,能根据具体成像应用需求,灵活选取与调控;其三,表面修饰精准可控,通过对单链聚合物进行特定官能团修饰,可实现suPdots的定量靶向修饰,将其与抗体偶联后,能够对多种亚细胞结构进行高特异性、高密度标记。
在实际应用中,借助受激辐射损耗超分辨荧光显微成像技术,该探针揭示了网格蛋白包被内凹小体的中空环状结构。依托suPdots的高亮度与超小尺寸优势,研究团队使用常规转盘共聚焦荧光显微镜,以50赫兹的时间分辨率和约8纳米的定位精度,解析了单个驱动蛋白在活细胞内的运动步长。
该研究克服了对复杂且昂贵的MINFLUX超分辨成像仪器的依赖,彰显了suPdots在推动纳米尺度单分子水平生物分子研究中的潜力。
相关科研成果发表在《自然-光子学》(Nature Photonics)上。
玻璃化冷冻制备suPdots
