研究揭示BRCA1-BARD1复合物识别DNA损伤位点的结构与分子基础
| 来源: 生物物理研究所 【字号:大 中 小】
DNA双链断裂(DNA double-strand breaks,DSBs)是真核细胞中最严重的DNA损伤类型之一,单个裸露的DSB即可诱发细胞凋亡。DSB主要通过非同源末端连接(NHEJ,non-homologous end-joining)和同源重组(HR,homologous recombination)两种方式进行修复。HR修复发生在S和G2期,受损的DNA以姐妹染色单体上的同源序列为模板进行修复,因此,HR修复是精确的修复方式,一旦发生缺陷将导致基因组不稳定,引起包括肿瘤在内的多种疾病发生。
乳腺癌易感基因BRCA1编码的蛋白促进DSB选择精确的HR修复方式,对于维持基因组稳定性十分重要。携带BRCA1种系突变的个体一生累计乳腺癌发病风险达80%,卵巢癌发病风险达40%~60%。近年来,在携带BRCA1或BRCA2突变的卵巢癌和乳腺癌治疗中得到广泛应用的PARP抑制剂(PARPi)便是利用“合成致死”效应靶向杀灭肿瘤细胞,其原理是PARPi导致细胞积累大量DNA单链断裂,单链断裂损伤在S期进一步转变为双链断裂,由于HR修复缺陷,这些双链断裂的DNA通过NHEJ快速连接修复,产生了大量错误的修复产物,达到杀死HR修复缺陷的肿瘤细胞并对正常细胞低毒害的效果。PARPi尽管可以针对性杀死HR修复缺陷的细胞,是一种颇具前景的低毒靶向药物,但它面临着适用性和耐药性这两个临床问题。深入研究细胞对DSB修复途径的选择机制有助于揭示相关癌症的致病机理,并将加速新型抗肿瘤药物的研发。中国科学院生物物理研究所研究员周政课题组此前研究揭示了组蛋白H4K20me2的识别调控对DSB修复途径选择的重要作用。
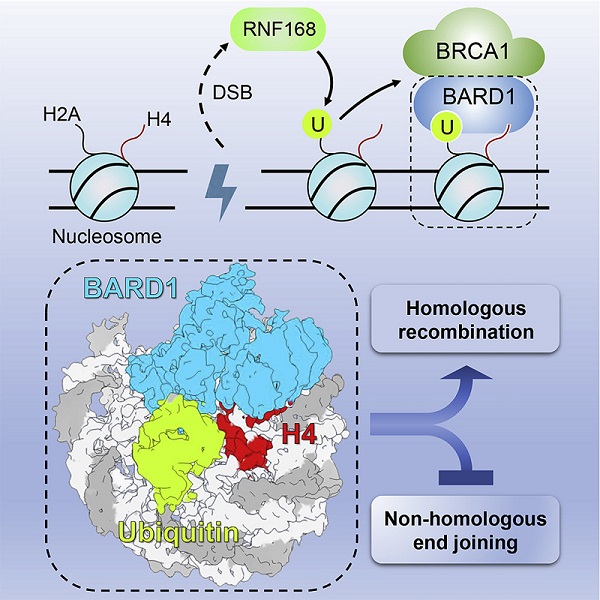
细胞对DSB修复途径的选择受到细胞周期的严格调控,NHEJ和HR修复途径在细胞周期的不同阶段发挥作用并维持基因组稳定性。为了确保遗传信息的准确传递,细胞倾向于选择更精确的HR途径对DNA复制期产生的DNA损伤进行修复,肿瘤抑制蛋白BRCA1与BARD1在HR途径的选择过程中发挥关键作用。研究表明,BARD1蛋白可以识别组蛋白H4第20位赖氨酸(H4K20me0)以及H2A第15位赖氨酸上的泛素(H2AK15Ub)形成的双重标记,并将BRCA1-BARD1二聚体定位到DSB附近的染色质,同时招募下游修复因子进行DSB修复。
6月7日,Molecular Cell在线发表了周政课题组与浙江大学教授黄俊课题组合作完成的研究论文Structural insight into BRCA1-BARD1 complex recruitment to damaged chromatin。该研究利用结构生物学、生物化学、生物物理学及细胞生物学等实验手段,揭示了BARD1对泛素化核小体的特异识别模式,阐明了BRCA1-BARD1复合物识别损伤染色质并促进同源重组修复的分子机制。
研究解析了BARD1与含有H4K20me0与H2AK15Ub双标记核小体的复合物电镜结构。结构表明,BARD1的ARD结构域与BRCT结构域横跨核小体的盘面,并与核小体的酸性区域、组蛋白H4以及泛素等存在广泛的相互作用。研究发现,BARD1通过识别泛素K63-E64位点,而非普遍存在的I44与I36位点与泛素结合,从而揭示了一种新的泛素识别模式。研究利用MST、EMSA和ITC等技术对上述作用界面进行了体外实验验证,揭示了BARD1识别H4K20me0和H2AK15Ub的结构基础。科研人员同时利用RNA干扰、免疫荧光与细胞存活等实验方法进行了体内功能验证,实验证明破坏BARD1-核小体相互作用会严重影响BRCA1-BARD1复合物在DSB位点的招募,致使HR修复效率下降,从而导致细胞对PARPi非常敏感。进一步研究发现,BARD1-核小体作用结合界面上存在多个癌症相关突变,提示BARD1突变可能会破坏细胞对DSB修复途径的选择,从而导致癌症的发生。
该研究揭示了BARD1特异识别泛素化核小体及其在促进同源重组修复过程中的重要作用,进一步探明了BRCA1-BARD1复合物介导的DSB损伤修复通路调控机制。该研究对于理解BARD1突变引起的DSB修复途径的异常选择,以及相关癌症的致病机理和抗肿瘤药物研发具有借鉴意义。
周政、黄俊为论文的共同通讯作者。周政课题组博士戴霖昌和戴亚鑫、黄俊课题组博士韩金花、周政课题组博士黄艳为论文的共同第一作者。周政课题组博士研究生王龙歌参与研究。研究工作得到国家重点研发计划、国家自然科学基金、中科院战略性先导科技专项(B类)等的资助。
BRCA1-BARD1复合物特异识别泛素化核小体并促进同源重组修复
