分子植物卓越中心发现植物免疫激活新机制
| 来源: 分子植物科学卓越创新中心 【字号:大 中 小】
近年来,病虫害频繁爆发造成作物减产和品质下降。而大量使用化学农药控制农作物病虫害,破坏生态环境,威胁人类健康。培育广谱抗病品种是保障粮食安全、发展绿色农业、维护生态环境的重要举措之一。发掘广谱持久抗病基因,揭示植物免疫激活调控广谱抗病的分子机制,是农作物抗病育种的重要理论基础。
11月8日,《科学》(Science)以“背靠背”形式在线发表了中国科学院分子植物科学卓越创新中心两项重要科研成果。中国科学院院士、分子植物卓越中心研究员何祖华团队与研究员张余团队,联合复旦大学研究员高明君团队、浙江大学教授邓一文团队完成了题为A canonical protein complex controls immune homeostasis and multipathogen resistance的研究成果。分子植物卓越中心万里团队完成了题为Activation of a helper NLR by plant and bacterial TIR immune signaling的研究论文。
植物免疫的本质是识别“非我”。植物免疫系统通过识别病原微生物进而激活自身的免疫反应。该系统由两道防线组成。一是通过植物细胞表面感受器识别病原菌后产生的基础抗病性(PTI),而PTI相对温和且易被病原菌分泌的毒性蛋白突破。二是在进化中植物产生第二道防线即植物细胞内感受器NLR蛋白识别病原菌分泌的毒性蛋白后引起的专化性抗性(ETI),而该防线反应强烈且能够赋予植物强抗病性。植物ETI免疫反应依赖于植物特定的NLR感受器蛋白识别特定病原菌分泌的特定毒性蛋白。当前,由于ETI的特异性,植物抗病育种和病虫害防治缺乏有效方法激活植物ETI。如何克服ETI对病原菌的特异性以及实现有效的多病原广谱抗病性成为植物免疫研究的重要课题。
前期,何祖华及合作团队发现了水稻免疫抑制基因ROD1。该基因突变引起活性氧积累,产生免疫自激活表型,提高水稻对多个病原菌如稻瘟病、白叶枯病和纹枯病的抗性。而对于ROD1抑制免疫激活的信号网络尚不清楚。该团队采用EMS化学诱变和γ射线物理诱变筛选rod1抑制子的策略,经过大规模的田间表型鉴定筛选,获得18个rod1抑制子株系。基因克隆和全基因组测序分析显示,这些抑制子分别是OsTIR、OsEDS1、OsPAD4和OsADR1基因突变。研究显示,禾本科作物的细胞内感受器OsTIR蛋白具有产生免疫小分子pRib-AMP的功能,而小分子pRib-AMP能够激活水稻OsEDS1、OsPAD4和OsADR1蛋白形成免疫复合体EPA以激发免疫反应。进一步,研究发现,水稻免疫抑制蛋白ROD1与OsTIR互作,影响OsTIR的酶活,从而抑制小分子pRib-AMP的生成,避免EPA复合体激发免疫反应,维持免疫的稳态。当病原菌侵染时,ROD1被降解,OsTIR蛋白被释放后生成小分子激活免疫复合体EPA,产生对多种病原菌的广谱抗性。该研究揭示了五组分的信号网络调控植物免疫稳态的分子机制,为培育广谱抗多种病原菌的作物新品种奠定了理论基础,提供了靶标基因。
无独有偶的是,万里团队发现了植物细胞内感受器的TIR蛋白可生成小分子2’cADPR。这类小分子作为前体在植物体内可以被转化生成pRib-AMP,从而激活EPA免疫复合体,提高植物抗病性。利用2’cADPR处理植物即可诱导类似于ETI的强抗病性,实现了在没有特定病原菌侵染的情况下人为可控地激活植物强ETI免疫反应。相对于pRib-AMP,2’cADPR性质更稳定,更适合开发为植物免疫激活剂。这为发展绿色农业提供了可以激发农作物广谱抗病性的新型“生物农药”,并能够替代化学农药,减少对生态环境的负面影响。同时,一些细菌的TIR蛋白可以产生2’cADPR并激活植物的ETI免疫反应,进而该团队揭示了植物和细菌免疫通路交互的分子机理。
植物细胞内感受器TIR蛋白介导的ETI抗性是农作物抗病育种的重要靶标。因此,研究植物免疫受体及其工作机理,实现对植物免疫受体的人工定向改造,能够解决植物病害问题。上述两项成果共同揭示了在不同植物中保守的由小分子pRib-AMP和蛋白复合体EPA介导的免疫激活新机制,为植物病害防控提供了新型“生物农药”靶标。
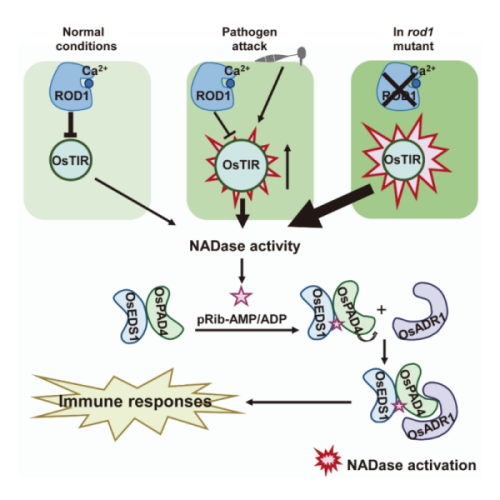
ROD1-OsTIR-EPA免疫级联模型
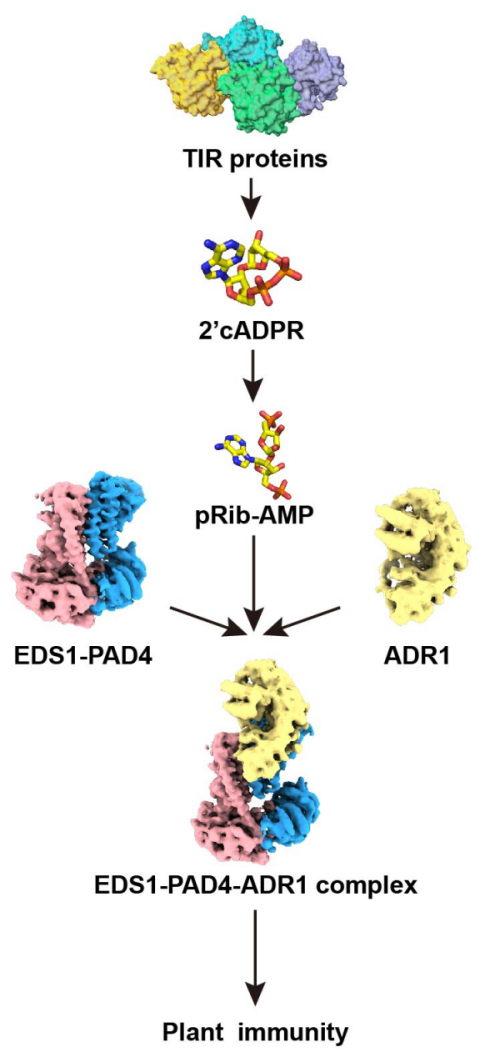
TIR蛋白产生2’cADPR并被转化为pRib-AMP进而诱导EPA复合体激活植物免疫反应
